植物病理学是研究植物病害的病原、发生、发展以及防治的一门应用学科。它以植物病害为研究对象,探讨发病的原因,或在解剖学、生理学或生物化学上,探讨感染和症状出现的过程。为了确立防病和治病的方法,还研究形成病原的环境条件、病原体传染途径以及病害的诊断法等,另外还研究防病的药剂对病原体或植物体的药理作用,以及包括所有与植物病害有关的广阔领域。多光谱成像系统是近年来出现的技术,可广泛应用于植物病理学研究,利用丹麦Videometer公司生产的VideometerLab多光谱成像系统发表的文章多达数百篇,VideometerLab含19个多光谱波段以及可见光波段,同时实现光谱以及图像成像。
中国的植物病理学是在生物学科中创建较早的一门学科,1917年就开始在高等农林教学中设置植物病理学课程。1929年中国植物病理学会成立,中国植物病理学会2019年学术年会暨学会成立90周年庆祝大会刚刚在成都举办。20世纪20~40年代,中国植物病理学戴芳澜、邓叔群、朱凤美、俞大绂等在研究中国真菌形态和分类,各主要作物的真菌、细菌和病毒病害,以及抗病育种等方面做出了贡献,在几个高等农业院校和研究所中建立了研究室,培养了许多植物病理学工作者,为中国植物病理学的发展奠定了基础。
当一株健全的植物受到干扰,导致器官和组织的生理机制局部的或系统的反常植物自身表现了病状(symptom),并能从患病部位提取出的物质具有相应病原物的病征(sigh),就是发生了植物病害。干扰植物正常生理机制的因素,主要是外来的,内在的因子导致遗传性病害;外来的因子有的是非生物性的,有的是生物性的。因此,根据诱发病害因子的本质,植物病害可分为非侵染性病害和侵染性病害两大类。
植物在长期的进化历程中,逐渐适应了各种不断变化的环境,产生了较强的适应能力。但对各类环境因素的适应能力有一定限度,如果植物所处的环境中某些物理如光照、水分、温度或化学因素如营养元素失调再货生存环境发生恶化,连续不断影响植物,其强度又较过植物忍耐限度,就会对植物的生长发育产生不利影响,扰乱正常生理和代谢活动,甚至对植物造成严重伤害,使植物在生理和外观上表现异常,产生病变。
侵染性病害是植物病原物在外界条件影响下相互斗争并导致植物生病的病害具有感染性。常见的植物病原体有真菌如黑粉病、锈病、白粉病等;卵菌如腐霉、霜霉等;原核生物以细菌为主如土壤杆菌、支原体、衣原体等;病毒如马铃薯Y病毒、黄征病毒、烟草花叶病毒等;高等植物如菟丝子、列当独脚金等;原生动物如线虫。其中以细菌、真菌、病毒、支原体和线虫诱发的病害较普遍和严重,尤以真菌性病害为较,如水稻的瘟病、小麦锈病、棉花的萎蔫病等。各种病原体的生理、生态、增殖方法和生活史以及侵染寄主的方式、途径和时期各不相同。
多光谱显微表型成像系统是一套能够实现微米级物体多光谱图像采集的仪器,它不仅保持了显微镜对微小区域实时成像的特点,具备了采集该区域物体280~1050nm波段内光谱以及RGB融合图像的能力,可普遍应用于微纳光学、材料学、生物技术等领域。下图为显微光谱测量系统整机图。

显微光谱测量系统可分为三个模块:照明模块、光谱接收模块以及成像模块。照明模块为10个-20个LED高功率光源组成,物体可获得明亮且均匀的全场照明。光谱接收模块以及成像模块为CCD相机,在测量光谱的同时,可以实现物体图像实时采集。
操作简便:多光谱显微表型成像系统同时具备多光谱测量和RGB测量功能模块;该系统可实现对微小物体的区域选择及定位(标配成像面积为3cmX3cm),分辨率可达1um/像素;测量能力强:具备传统显微镜所不具备的显微多光谱测量功能,传统显微镜只能提供图像的获取,从而对物体进行形貌分析,该系统额外具备目前*表型成像技术,可对形态、尺寸等进行有效测量,获得物体的显微多光谱信息。多光谱显微表型成像系统,在保有物体图像采集的功能外,还可对物体进行不同区域光谱的采集与分析,较进一步的了解物体的纹理、结构与特性;扩展功能多:包含显微尺度的透反射、荧光等显微光谱测量,较大限度满足各类的科研需求。
快速、无损检测
包括处理在内每样品处理仅需10-20秒
与其它破坏性技术组合
高灵活性测量
主要专注:可重复洗、可追溯性、耐用性、可传递性
显微荧光标记检测
VideometerMic多光谱显微表型成像系统是一套突破性的多光谱成像系统。采用了少有的光谱成像检测技术。在提高信噪比和多靶点标记的检测方面,*克服了传统成像技术的限制。可应用于植物、细胞、基因或蛋白芯片等研究领域,是一套功能强大的成像系统。该基础模块包括10个-20个散射波段,波长范围为280-1050nm,摄像头可固定或移动,集成的多光谱传感器安装在XYZ平台上,实现30cmX30cm的样品自聚焦和扫描,可测量较小的样品,可用于拟南芥种子、细菌、真菌、虫卵、细胞等成像。
VideometerMic多光谱显微表型成像系统将传统多光谱成像系统升级为多光谱成像系统。该系统具有强大荧光标记的检测、分离和分析功能。在分析过程中,通过系统设置的激发光源组和内置在10-20位滤波轮中的一系列滤波器激发植物样品中各种发色团的动态荧光。样品激发出的荧光经显微镜放大后进行荧光光谱分析和成像分。
VideometerMic多光谱显微表型成像系统是目前功能强大、全面的多光谱显微表型成像系统,可以进行微藻、单个细胞、单个叶绿体甚至基粒-基质类囊体片段进行图像荧光分析;还能通过激发光源组进行进行任意荧光激发和荧光释放波段的测量,从而进行GFP、DAPI等荧光蛋白、荧光素以及藻青蛋白、藻红蛋白、藻胆素等藻类*荧光色素的成像分析;较可以利用光谱仪对各种荧光进行光谱分析,区分各发色团。
VideometerMic多光谱显微表型成像系统是一款跨越微观与宏观表型研究的系统,结合了显微镜和多光谱表型成像特征,使科研工作者在细胞和亚细胞层次深入理解植物生理表型,VideometerLab 4的所有表型工具均适用于该系统。
专有设计,实现微米级区域内的透反射光谱测量、荧光光谱测量。
反射显微多光谱测量:通常使用系统高功率LED灯作为照明光源,对接收到的反射光进行采谱及分析。
透射显微光谱测量:通常使用系统高功率LED灯作为照明光源,对接收到的透射光进行采谱及分析。
荧光显微光谱测量:系统自带滤波轮,进行荧光激发和分析。
系统放大可达40倍,可以清晰观测到叶绿体及其发出的荧光,统计叶绿体数量等等。
激发光源组中包括红光、蓝光、绿光、白光、紫外光和远红光等,通过红蓝绿三色光还可以调出可见光谱中的任何一种色光,能够研究植物体中任何一种色素分子或发色团。
高灵敏度CCD镜头
集成高分辨率多光谱能够深入解析各种荧光的光谱图。
荧光及明场多色标记应用领域;量子点探针的应用领域;分子病理学研究领域;植物学研究领域;植物病理学领域;表型性状分析/挖掘,基因型-表型关联;农业育种;园艺学、农业信息学;果实品质分析;植物病理研究;生物量分析;种子萌发研究;抗逆研究;植物应用领域;显微结构的植物生理研究;植物逆境研究;生物和非生物胁迫的研究;植物抗胁迫能力及易感性研究;突变体筛选及光合机理研究;藻类长势与产量评估;藻类*色素;植物—微生物交互作用研究;植物—原生动物交互作用研究;基因工程与分子生物学研究 ;测量植物样品;花粉分析;植物活体切片;植物表皮;植物细胞;绿藻、蓝藻等各种单细胞和多细胞微藻;叶绿体提取液;类囊体提取液;含有叶绿体的原生动物。
小麦是重要的作物之一,对全球食品安全至关重要。“Take-all "根病害是由子囊菌真菌Gaeumannomyces tritici(Gt)致病,可穿透根并毁坏维管系统。形成的黑色坏死斑破坏了养分和水吸收,导致减产达60%。其它密切相关子囊菌真菌品种,例如G. hyphopodioides(Gh),却是对抗“take-all"病的生物控制剂。
G.hyphopodioides可侵染外皮质根层,但与“Take-all"不同,其不会侵入到中间部位,特征是在菌表面和亚皮下囊泡形成灰色菌丝。
来自英国的科学家研究重点是对高级成像技术进行评估,以对根定植进行真菌检测和精确定量,通过测量光合参数评估对地上部健康的影响。研究中使用了VideometerLab 多光谱成像系统。

图中显示“Take-all"感染小麦幼苗。左侧是原始图像,有红色箭头标示“take-all "损失,用手工评分;右图是相同图像经‘VideometerLab’分析,将根组织分类为感病(蓝色)和健康(桔色/黄色)。
具体实验步骤:
A 5-week time-course seedling pot bioassay was set up using 250g of soil from Webb’s Field on the Rothamsted Farm, UK.
An artificial inoculum layer derived from PDA plates contained Gt, Gh or an uncolonised control. The pots were baited with 10 seeds of the wheat c*r‘Hereward’, and kept in a controlled environment room. Each week, the pots were visually assessed for the presence of necrotic lesions, greying and vesicles. The level of infection was recorded as the proportion of roots showing at least one area of fungal colonisation, making this a semi-quantitative method of assessment. Potentially, imaging could provide a more efficient method to assess root colonisation, allowing the affected root area to be accurately quantified and also removing the subjectivity that can be associated with manual scoring. Consequently, a key question was: can multispectral imaging be used to quantitatively assess and distinguish between Gt and Gh seedling root colonisation?
Multispectral imaging was accomplished using a ‘VideometerLab’ imager, a system that uses 19 different wavelengths ranging from UV to the NIR. Training images were taken of healthy roots, and those colonised with Gt or Gh. These training images were used to build statistical transformations, which were subsequently used to score pixels as corresponding to healthy or colonised root tissue. The threshold pixel score chosen ensured that, in the case of Take-all, only the dark black lesions were scored. The ‘VideometerLab’ and visual assessments of Take-all colonised roots showed a significant correlation (Spearman’s Rank, Rs = 0.670, p = <0.001, n =24). Interestingly, whilst low, the Take-all scores for the uninoculated, control plants, were consistently higher using the image-based scoring. It is possible that the ‘VideometerLab’ was detecting other fungal colonisation phenotypes caused by contamination in the soil which were not visible to the human eye. The ‘VideometerLab’ struggled to distinguish the root greying caused by Gh from mild Take-all symptoms and preliminary analysis has shown that the root greying phenotypes associated with the presence of both fungal species have similar pixel scores across all wavelengths. However, the dark necrotic Take-all lesions had a distinct spectral signature, supporting the validity of our method for scoring Take-all.
Prior to harvesting the roots for the imaging described above, a LemnaTec ‘PhenoCenter’ was used to evaluate the impact of fungal root colonisation on above ground plant health. Specifically, a PAM fluorescence camera was used to evaluate photosynthetic efficiency in the foliage. This technique is based on the observation that light energy absorbed by photosystem II can be dissipated via three routes: photochemical reactions, dissipated heat or as fluorescence – it’s the competition between these processes which is exploited to quantify photosynthetic parameters. While a small reduction in photosynthetic efficiency was observed for the Take-all infected plants, no significant difference was observed between the Gh and control pots. These are encouraging results as it would be undesirable for Gh to impact photosynthetic efficiency if used as a biocontrol agent.
藜麦(Chenopodium quinoa)是一种作物,营养丰富,在多个国家广有种植。真菌病如霜霉病限制了谷物产量,培育抗性品系,如抗霜霉病品系是藜麦育种的中心目标。
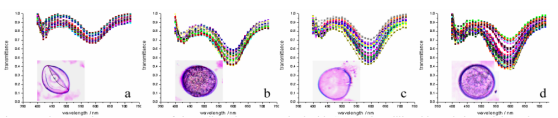
利用常规RGB成像来测量藜麦对霜霉病的表型反应(Peronospora variabilis ) 测量比较困难,原因在于来自不同藜麦基因型在叶片上有不同绿色和红色斑点进行干扰,参见图1和图2。
开发图像分析规程来区分健康藜麦叶片组织以及感染霜霉病的藜麦叶片组织。研究利用Videometer多光谱成像系统对严重度程度表型和孢子形成进行研究。
严重程度是叶片正面损伤的面积占整个叶片面积的百分比。依基因型不同,颜色可为桔色、黄色或红色。
孢子形成是损伤部上方孢子量,以百分比测量,通过测量叶片正面进行评估。
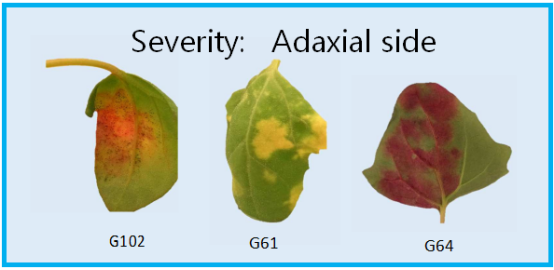
图1 叶片正面严重度症状

图2 叶片正面孢子形成
研究人员利用VideometerLab 4多光谱成像系统进行多光谱成像,积分球确保对样品的均一照明(图3)。每个获取的图像层由19个不同图像波段组成,波长涵盖365nm(UVA)到970nm(NIR)。图像的每个像素分辨率为~41 µm。每个图像层的分辨率为2192X2192像素。
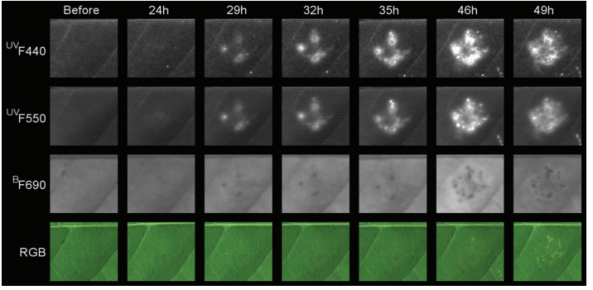
从G9基因型叶片正面(图4)清楚看到了黄化现象(A),拍摄了RGB图像(常规相机,人眼可见光波段。(B)和(C)显示了多光谱图层中的2个波段,蓝光490nm(B)和黄光570nm(C)。对健康植物组织和黄化界定进行了初始标记,转换建立了模型(D),通过nCDA(归一化典型判别分析将19个波段信息(图像中多个图层),转换为了整个图层的代表像素范围值。之后切割(E和F),可用于所有图像-所有品系和基因型,获取有黄化组织(E黄色)百分比定量分析,该特定叶片比例为68.0%,或者包括红色覆盖孢子区(F),比例为18,9%,黄化(黄色)比例68%,孢子和黄化区综合面积占比75.8%。
在叶片正面(底部),RGB图像中的G9基因型清晰可见到孢子形成图像(下底部A和B放大)。尽管在可见光波段很难检测到单个波段,这里特别标出了蓝光波段(490nm)(C)。进入NIR(780nm)波段(下左部的D和E放大),清晰看见了孢子。使用该信息(仅标识黑灰色孢子)可帮助我们区分切割孢子像素(F),并将该面积定量,该叶片孢子比例为12.5% (黄色显示),不包括黄化部分面积。
另外,此处的孢子标识与正面图像分析而言更加保守。 覆盖的非黑灰区的像素部分 (像素比单个孢子要大)估计,孢子比例为~23%(此处未予以显示)。

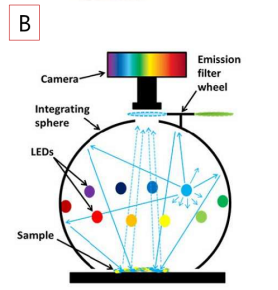
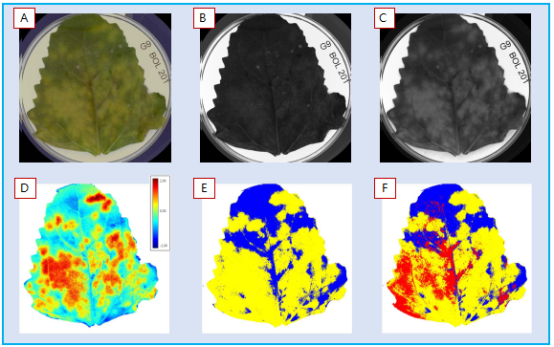
图4(A) sRGB图像。(B),490nm(蓝光),(C),570nm(黄色),(D) 转换,(E)和(F),2种类型定量分割。
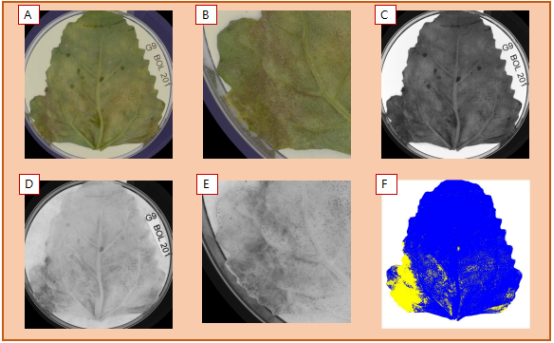
图5(A) sRGB 图像,(B)490nm(蓝光),(C) 570nm(黄色),(D)转换,(E)定量分割。
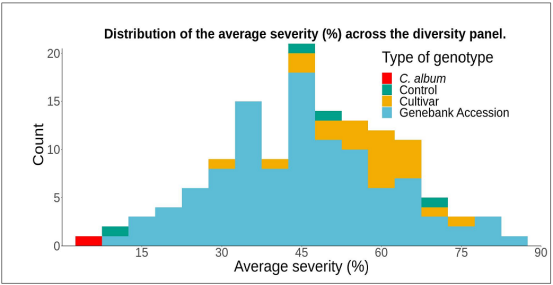
图6:133个基因型的平均严重程度(%)分布
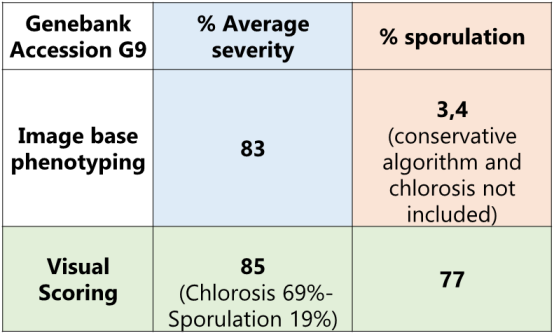
表1手工以及基于多光谱表型成像的藜麦霜霉病互作
研究对相关的132个藜麦基因型对霜霉病的表型反应进行了研究。设置了3个实验,每个有4个区块,配有复制控制样品以及非复制基因型样品。找到了对P. variablilis 反应变异大的藜麦基因型,发现了基因型对互作有着显著影响 (p-value = 1.18 x 10-18) 图6。研究人员对图像表型研究结果进行了比较,研究人员正在开发适合覆盖整个反应的算法。该综述中,研究者展示了与G9基因型相对应的叶片图像。结果总结在表1中,来不同区块和试验的分属不同植株的10片叶子取了平均值。
多光谱成像如严格按照规程使用、记录完善的话,是非常强劲的表型工具。对图像定量基于算法应用,这需融合对疾病反应的经验和知识。对孢子形成,菌丝萌发,渗透,侵染面积以及健康组织识别可提供更加近似的像素标识。
目前研究人员已经开发出了可应用于藜麦霜霉病互作的应用于损伤组织算法。
科学家开发了一种多光谱成像算法来评估小麦对镰刀菌(F. graminearum and F. culmorum)的抗性。获取结果与VDA方法视觉疾病评估)和qPCR方法进行了比较。研究目标是选择新型、快速的表型方法来替换现有评价的VDA抗性评估方法。
视觉疾病评估方法与Videometer在不同生理阶段对麦穗和群体的相关性(360-1050nm)
比RGB成像区分效果要好

VideometerLab® 以及传送带
2056x2056 像素/波段
1000粒种子扫描仅需5-10 min
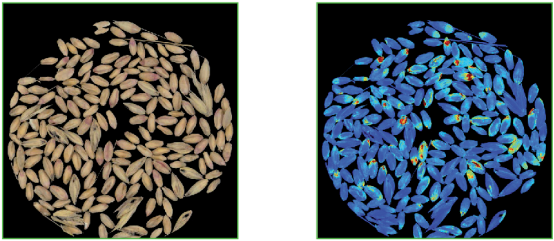
感染镰刀菌小麦粒 CDA图像
基于典型判别分析(CDA)分析感染麦粒(黄/红),未感染 (蓝色)
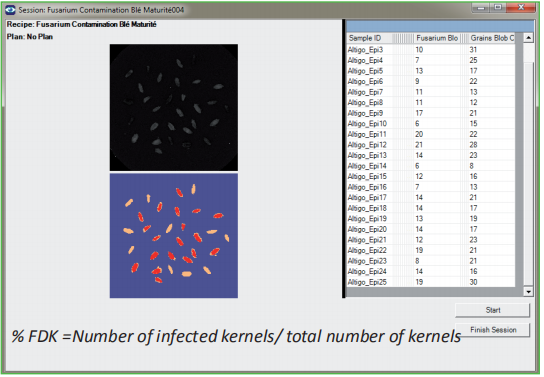
-分类像素的阈值化
-Excel 结果输出
实验设计:
- 喷洒接种:F.graminearum & F. culmorum
- 冬小麦: 5栽培种 (抗性控制)
- 25 麦穗(2个重复)(使用 VDA和 Videometer)
田间视觉评分:
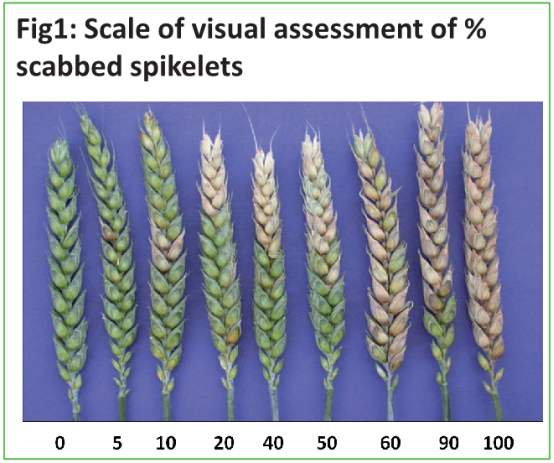
360°C dpi : % 结痂小穗 ; % FDK
成熟 : % FDK
Videometer : % FDK
培养皿
-单穗:第1次重复25穗/cv
-散装:≈从第2个重复的25个穗中收集1000粒/cv
传送带
‒散装≈从第二次重复的25个穗中收集1000粒/cv
qPCR
-5个品种≈第二次复制的1000粒/cv
-研磨每个品种的所有果仁,并从50 mg面粉中提取DNA
-具有特定TaqMan的qPCR® F.graminearum的探针
在不同生理期的不同个体麦穗和群体
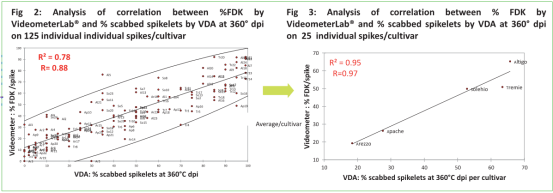
% 结痂麦穗s & % FDK
单个麦穗 &群体
‒ Videometer: 培养皿 & 传送带
‒ 360°C dpi评分 & 成熟
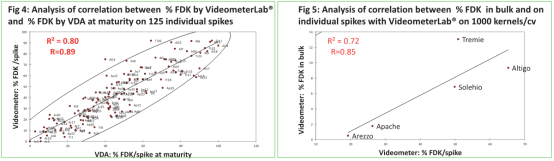
VDA (360°C麦穗和麦粒成熟) 与Videometer在麦粒成熟度上有很强相关性,以下模块:
‒单独麦穗& 群体
‒ Videometer带培养皿和传送带
在其它试验中,用F. graminearum接种,观察到了Microdochium spp自然侵染的微弱相关性。
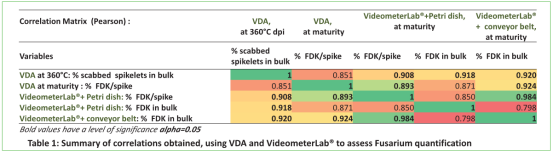
2.qPCR, VideometerLab® 和VDA的疾病评估相关性。
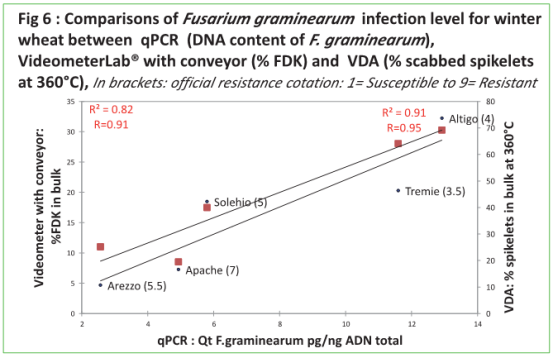
在qPCR 于带传送带的Videometer 评估群体采集麦粒之间有高度相关性(R=0.91),qPCR与 VDA 在 360°Cdpi也有高度相关性(R=0.95),验证了VideometerLab® 在成熟阶段麦粒精确评估、快速定量镰刀菌的能力,这与抗性分类相一致。
使用VideometerLab®集合开发算法,在评价感染镰刀菌(Fusarium graminearum)和culmorum 的抗性时取得了很好的结果。更多时间将在更多品系小麦以及谷物上进行。针对该应用还可开发更多的算法。